世界衛(wèi)生組織官網(wǎng)最新數(shù)據(jù)顯示,截至歐洲中部時間8月2日17時19分,全球新冠累計確診病例達198,234,951例,累計死亡病例4,227,359例。最早在印度發(fā)現(xiàn)的新冠變異病毒Delta毒株快速蔓延,為歐洲抗疫帶來諸多考驗。世衛(wèi)組織7月28日表示,在過去一周,又有8個國家和地區(qū)發(fā)現(xiàn)Delta變異株,該變種病毒已傳播至132個國家和地區(qū),多國政府和專家呼吁民眾嚴格遵守防疫措施。
世界疫情防控形勢依舊嚴峻,防疫資源緊缺、檢測效率低下等問題依然突出。梅奧診所(Mayo Clinic)于今年2月開啟了一項關(guān)于新冠抗原檢測試劑性能的研究評估,在全球范圍內(nèi)選取了BD、艾康生物、LumiraDx 3家公司的4款產(chǎn)品作為研究對象,并于7月8日在權(quán)威雜志Clinical Chemistry上發(fā)表最新研究報告。
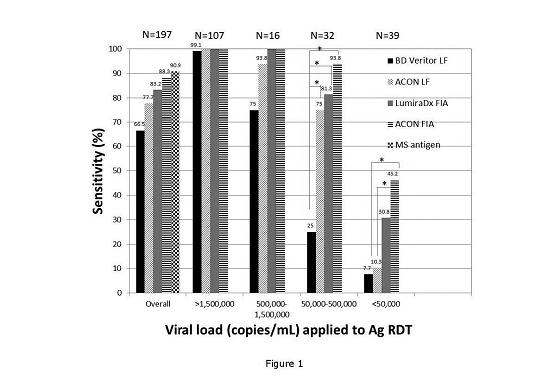
報告顯示,相較于其他兩家公司的檢測產(chǎn)品,艾康生物Flowflex? 新冠病毒抗原檢測試劑(LF)和 FIAflex? 新冠病毒抗原檢測試劑(FIA)無論是靈敏度還是樣本檢測率,都更勝一籌。與金標準RT-qPCR 相比,所有抗原快速檢測試劑的特異性接近 100%。總體靈敏度對比分析結(jié)果在 66.5% 到 88.3% 不等。在病毒載量 >1,500,000 拷貝/mLRNA 的樣本中,所有方法學(xué)產(chǎn)品均檢測到抗原,病毒載量在500,000 至 1,500,000 拷貝/mL 的樣本中檢測率≥75%(其中艾康生物L(fēng)F產(chǎn)品和FIA產(chǎn)品分別為93.8% 和100%)。病毒載量在 50,000-500,000 拷貝/mL之間的樣本中,BD Veritor LF產(chǎn)品僅檢測到25%,艾康生物 LF產(chǎn)品檢測到75%,LumiraDx FIA 產(chǎn)品為81.3%,艾康生物 FIA 產(chǎn)品高達93.8%。而在病毒載量 <50,000 拷貝/mL 時,對比其他公司,艾康生物 FIA產(chǎn)品檢測到的陽性樣本明顯更多。
之所以能夠在測試中得到更好的效果,與艾康生物一直以來的企業(yè)使命及Flowflex? 抗原檢測系列試劑應(yīng)用的專業(yè)技術(shù)密不可分。
今年6月份,美國著名醫(yī)療器械信息平臺MedtechDive發(fā)表了一篇文章,標題是“雅培Abbott抗原新冠試劑Panbio在愛爾蘭一個調(diào)研中被發(fā)現(xiàn)只能檢測出50%的無癥狀新冠患者”。同時,最近在美國被FDA封殺的Innova抗原試劑, 也在最近一個英國的調(diào)研中被發(fā)現(xiàn),對于無癥狀新冠患者的檢測率只有48.9%。這兩份研究報告對于快速新冠抗原自檢試劑在全球推廣產(chǎn)生了很大的負面影響,同時也使得歐洲提高了抗原自檢試劑進入歐洲的門檻。而在7月份,全球POCT診斷頭部公司Quidel因其新冠檢測產(chǎn)品出現(xiàn)假陰性結(jié)果,被FDA緊急一級召回(最嚴重的類型),并指出使用該檢測產(chǎn)品出現(xiàn)假陰性結(jié)果可能導(dǎo)致已感染新冠病毒 的患者診斷延遲或治療不當,使得患者陷入重癥甚至死亡風(fēng)險,并擴大新冠病毒在社區(qū)中進一步傳播。行業(yè)中良莠不齊的質(zhì)量問題頻頻出現(xiàn),再度引起國際相關(guān)藥監(jiān)部門和政府的重視,各國都對抗原自檢試劑入市提高了門檻。
作為一家擁有二十余年生物技術(shù)研發(fā)經(jīng)驗的IVD企業(yè),艾康始終將嚴把質(zhì)量關(guān)作為最高執(zhí)業(yè)準則,新冠抗原檢測試劑已獲得CE、BfArM、PEI、NIFDC等多重認證。疫情爆發(fā)一年多以來,艾康生物為全球范圍內(nèi)各國的疫情防控工作做了突出貢獻。在此次新冠Delta變異株的防控工作中,也將再次助力歐洲各國乃至全球建立起疫情防控新屏障。
本文為企業(yè)推廣,本網(wǎng)站不做任何建議,僅提供參考,作為信息展示!
推薦閱讀:旗龍網(wǎng)

網(wǎng)友評論
請登錄后進行評論|
0條評論
請文明發(fā)言,還可以輸入140字
您的評論已經(jīng)發(fā)表成功,請等候?qū)徍?/p>
小提示:您要為您發(fā)表的言論后果負責(zé),請各位遵守法紀注意語言文明